Неврология, психиатрия и оксидативный стресс. Защитные свойства «Гитагамп — Рутин Железо GRuI»
И.Г. Гитлин, Е.З. Гольдберг Закрытое акционерное общество «нпк эхо»
Гитлин Исаак Григорьевич / info@npk-echo.ru
Ключевые слова: неврология, дыхательная недостаточность, радиопротектор, активные формы кислорода (АФК), нейродегенеративные заболевания.
Резюме: С окислительным стрессом связывают развитие многих заболеваний, включая болезнь Альцгеймера, Паркинсона, бокового амиотрофического склероза, а также сердечно-сосудистые заболевания 1, 2, 3. Недавняя публикация4 в журнале Практическая Медицина о новом антиоксиданте, побудила нас продолжать изложение уникальных особенностей соединения. В предлагаемых исследованиях свойств Гитагамп-Рутин Железа, активный компонент - RuFe3AA0.5Ctr5 (Цитрат рутин-железа(III)-аскорбиновой кислоты), проявляет как радиопротекторные свойства, так и оказывает воздействие на парциальное давление кислорода в здоровой мышечной ткани. В данном исследовании мы показываем что Гитагамп-Рутин Железо позволяет значительно снизить концентрацию перекиси водорода до нормальной. Мы надеемся, что наш вывод будет представлять интерес для врачей и исследователей в области неврологии.
Введение
Воздействие на организм ионизирующего излучения (малые и средние дозы) и оксидативного стресса (стрессы от физических или нервно-психологических нагрузок) протекает c подобным механизмом воздействия на организм.
Стадии воздействия радиоактивного излучения на биологические объекты: Физическая — поглощение энергии излучения; образование ионизированных и возбужденных атомов и молекул 10–16 — 10-15 с.
Физико-химическая — перераспределение поглощенной энергии внутри молекул и между ними, образование свободных радикалов 10-14 — 10-11 с.
Химическая — реакции между свободными радикалами и между ними и исходными молекулами. Происходит образование широкого спектра молекул с измененными структурой и функциональными свойствами 10-6 — 10-3 с.
Биологическая — последовательное развитие поражения на всех уровнях биологической организации от субклеточного до организменного. Секунды — годы.
Время жизни возникающих частиц составляет от долей наносекунд до секунд для сравнительно долгоживущих частиц. Так NO-нитроксильный радикал-10-1 сек, RO органические перекиси — 10 сек, Н2Н2
Основным поражающим фактором радиационного воздействия является воздействие пероксида водорода (стандартный окислительно-восстановительный потенциал (ОВП) — 1.77В относительно насыщенного водородного электрода).
При моделировании окислительного стресса используют прием добавления пероксида водорода в культуральную жидкость7,8. При этом оптимальной конечной концентрацией Н2Н2
Нейтрофил является ключевой клеткой в развитии ОВ. С одной стороны, он относится к клеткам-эффекторам очага воспаления, где запускает целый каскад молекулярных механизмов, от которых зависит, перейдет ли процесс в хроническую фазу или наступит разрешение воспаления. С другой стороны, нейтрофил выступает продуцентом веществ, принимающих участие в развитии и поддержании воспаления, к числу которых относятся: активные формы кислорода (АФК), ферменты азурофильных и специфических гранул, провоспалительные цитокины (фактор некроза опухоли α (TNFα), интерферон, интерлейкины (IL) -1, -8 и др.), лейкотриены, простагландины, факторы сосудистой проницаемости и иные биологически активные вещества9,10,11.
Дисфункции нейтрофилов приводят к тяжелым формам подверженности больных бактериальным инфекциям, что подчеркивает ключевую роль нейтрофилов в обеспечении врожденной формы иммунитета. С другой стороны, гиперактивация нейтрофилов также приводит к патологиям. Такие аномалии, как повреждение при реперфузии. Примерно в 30% подобных наблюдений развивается так называемый «синдром реперфузии», обусловленный неспособностью энергетической системы кардиомиоцитов утилизировать поступающий кислород и субстраты синтеза АТФ. Синдром дыхательной недостаточности взрослых дыхательная недостаточность — состояние, характеризующееся нарушением нормального газового состава артериальной крови: доставки достаточного количества кислорода в артериальную кровь и выведения соответствующего количества углекислого газа из венозной крови в альвеолы. Нарушение легочного газообмена приводит к уменьшению раО2(гипоксемии) и увеличению раСО2(гиперкапнии). Диагностический критерий острой дыхательной недостаточности — снижение раО2 ниже 50 мм рт. ст. и/или раСО2 больше 50 мм рт. ст. при отсутствии внутрисердечного шунтирования.
На рис. 1 приведен пример Кривой диссоциации оксигемоглобина.
Вид этой кривой диссоциации оксигемоглобина обычно определяется такими параметрами как значение температуры Т, рН, парциальное давление СО2. Вполне справедливо представление существования газообразного кислорода в плазме крови как системы, создающей определенный окислительно-восстановительный потенциал12,13. Естественно рассматривать окислительно-восстановительный потенциал (ОВП) как один из параметров гомеостаза. Влияние на ОВП производят все системы, поскольку окислительно-восстановительные процессы вовлечены в систему жизнеобеспечения организма. Значение ОВП относительно насыщенного водородного электрода составляет примерно 200 мВ. Реальная картина представляет собой довольно сложное взаимодействие многих факторов как окислительной так и восстановительной природы, для представления интегрального значения результирующего значения окислительно-восстановительного потенциала можно воспользоваться вилом Лютера.
Правило Лютера позволяет рассчитывать электродные потенциалы труднореализуемых реакций без непосредственного измерения.
Общее правило: увеличение активности веществ Ox сдвигает электродный потенциал в «плюс», а увеличение активности веществ Red сдвигает электродный потенциал в «минус».
Правило Лютера: произведения nEi аддитивны, что вытекает из аддитивности ΔG и соотношения
ΔG0 = –nFE0
Е0 = = — ΔG0/nF,
где ΔG0 — стандартное изменение свободной энергии Гиббса.
На практике для определения окислительно-восстановительного потенциала строят электрохимические цепи из некоторого стандартного электрода и электрода, на котором протекает соответствующий редокс-процесс. В водных растворах в качестве стандартного используют водородный электрод. В такой цепи эдс приравнивается к значению окислительно-восстановительного потенциала и выражается уравнением Нернста:
где ai — активности участников редокс-процесса, vi — их стехио-метрич. коэффициенты, R — универсальная газовая постоянная, T — абсолютная температура, F — число Фарадея, причем для исходных в-в принимается vi<0, а для продуктов р-ции vi >0. Стандартный потенциал Е0 равен окислительно-восстановительному потенциалу при активностях (или/и фугитивностях) компонентов, равных единице, и зависит от природы редокс-процесса и от температуры. Таким образом, окислительно-восстановительный потенциал (ОВП) можно рассматривать как меру стандартной свободной энергии редокс-процесса.
Изменение значение потенциала гипотетического кислородного электродапри значениях парциального давления кислорода 30; 20; 10 мм рт. ст. по сравнению с физиологически нормальным рО2=40 мм рт. ст.
Зависимость электродного потенциала кислородного электрода от рН
Р(О2) — парциальное давление кислорода, атм; а`ОН¯ — активность гидроксильных ионов; F — число Фарадея (96500 г×экв); R = 8,31 Дж/(К×моль) — газовая постоянная; T — абсолютная температура, К. Для температуры 370С и при значении рН=7,4
ЕО2= 0,774 +0,0154lg рО2;
В норме гомеостаз — способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия поддерживает постоянными основные параметры.
Согласно принципу Ле Шателье — Брауна, если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, окислительно-восстановительный потенциал), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. При увеличении концентрации пероксида водорода или гипохлорита натрия, для поддержания окислительно-восстановительного потенциала, в системе происходит уменьшение равновесного парциального давления кислорода как наиболее доступного для регулирования фактора. Естественная система защиты (ЕСЗ) организма от действия перекисей определяется кооперативным действием ферментов, белков и низкомолекулярных соединений14: В силу генетических особенностей или возрастных изменений в организме, ЕЗС не обеспечивает необходимые защитные функции. В энергетической системе организма образуется некоторый стационарный избыток перекиси водорода по сравнению с состоянием молодого здорового организма.
Материалы и методы
Защитные свойства препарата Гитагамп Рутин Железо (GRuI) были охарактеризованы двумя стандартными методами определения концентрации перекисных радикалов: в растворе — по окислению люминола (1) и внутри клеток человека — по окислению 2’7’дихлорофлюоресцеина (2).
Способность препарата GRI разлагать перекись водорода в растворах производилась в стандартной среде для культивирования клеток DMEM с 10% сыворотки. Для этого в культуральную среду, содержащую перекись водорода (350 мкМ), добавляли GRI до концентрации 0,375 мкг/мл. Через определенные промежутки времени производили отбор аликвот среды, где по окислению люминола определяли содержание перекиси (см. табл.). Представленные результаты показывают, что GRI в отличие от контрольного препарата уже в первые минуты вызывает резкое снижение содержания перекиси водорода в среде и полностью элиминирует перекись уже через 4 часа после добавления.
Поскольку GRuI продемонстрировал выраженные защитные свойства, мы предположили, что данный препарат также будет препятствовать накоплению экзогенных перекисей внутри клеток. Для проверки нашего предположения в культуральную среду клеток НСТ-116 (клетки рака толстой кишки) вносили GRuFe (до концентрации 0,375 мкг/мл), через 1 час инкубации добавляли перекись водорода (до концентрации 700 мкМ). Еще через 4 часа методом проточной цитометрии по флюоресценции окисленного 2’7’дихлорофлюоресцеина в клетках было определено относительное содержание перекисных радикалов.
Как видно по расположению пиков флуоресценции, добавление GRuI в среду клеток, обработанных перекисью водорода уменьшает содержание внутриклеточных перекисей до уровня отрицательного контроля (клеток не обработанных перекисью).
Методы Клеточные линии
В работе использовали клеточные линии HCT-116 (рак толстой кишки), культивировали с использованием среды DMEM, с добавлением 10% эмбриональной бычьей сыворотки, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина.
Определение выживаемости клеток методом окраски метиленовым синим
Клетки в монослое фиксировали метиловым спиртом и затем окрашивали метиленовым синим (0,5% метиленовый синий в 50% метаноле). Относительную выживаемость клеток оценивали спектрофотометрически (по разнице значений измерений, произведенных при 650 нм и 540 нм) после экстракции метиленового голубого 1%-ным раствором SDS (1).
Определения количества перекисей по окислению люминола
К аликвотам среды добавляли 15 мкМ люминола и пероксидазу хрена (8mU/ml). Интенсивность люминесценции определяли при помощи прибора Wallac 1420 (2).
Определение количества внутриклеточных перекисных радикалов
2x106 клеток НСТ-116 инкубировали в темноте в присутствии 2,5 мкМDCF при 37°C в течение 30 минут. После инкубации клетки дважды отмывали фосфатно-солевым буфером, трипсинизировали и анализировали на проточном цитометре (BD FACSCalibur) (3).
1. Скорость разложения
перекиси водорода
Перекись водорода добавлялась:
Контроль к культуре клеток НСТ-116 (клетки рака толстой кишки)
Рутин к культуре клеток НСТ-116 и Рутину (0.375мг/мл)
Гитагамп RuFe к культуре клеток НСТ-116 и Гитагамп RI (0.375мг/мл)
2. Защитное действие
«Гитагамп–RuI»
Клетки HCT-116 обрабатывали при внесении 50 мкг, 5 мкг и 0.5 мкг «Гитагамп — RuI» на лунку 1 час и вносили перекись в количестве 150 мкМ, 350 мкМ, 700 мкМ.
Результат регистрировали через 20 часов.
Поскольку препарат GRuI оказался эффективным антиоксидантом мы предположили, что его добавление к клеткам, позволит увеличить их выживаемость в условиях оксидативного стресса. Клетки HCT-116 рассевали на 96-луночный планшет в количестве 5х104 на лунку. Через сутки клетки обрабатывали «Гитагамп — RuI» (500 мкг, 50 мкг и 5 мкг на 1 мл культуральной среды) в течение 1 часа и вносили перекись в количестве 150 мкМ, 350 мкМ, 700 мкМ. Результат регистрировали через 20 часов.
Наблюдаются выраженные защитные свойства 500 мкг «Гитагамп — RuFe» от оксидативного стресса, вызванного 700 мкМ Н2О2.
III. Радиопротекторные свойства «Гитагамп — Рутин Железо» GRuI. (ГНЦ — Институт биофизики, Москва, Научно-исследовательский институт им. Гамалея РАМН, Москва.
Известно, что одним из основных повреждающих факторов, сопутствующих радиационному поражению в условиях in vivo, является оксидативный стресс. Выраженные антиоксидантные свойства препарата «Гитагамп — Рутин Железо» и его способность увеличивать выживаемость клеток в условиях оксидативного стресса в условиях in vitro позволили сделать предположение, что данный препарат может использоваться в качестве радиопротективного средства.
Проверку радиопротекторных свойств «Гитагамп — Рутин Железо» проводили на мышах линии С57/Black6 весом 18-22 г. Две группы мышей, по 10 в каждой, получили дозу гамма облучения 8 Грэй каждая. Испытуемая группа получила перорально по 10 мг «Гитагамп — Рутин Железо» за четыре часа до облучения.
В контрольной группе на момент прекращения наблюдений потери составили 5 мышей, в испытуемой группе — 2.
I. Влияние «Гитагамп — Рутин Железо» (GRI) на степень оксигенации здоровой мышечной ткани животных (Московский научно-исследовательский онкологический институт им. П.А. Герцена)
Исследование проводились на мышах гибридах F1 (CBAxC57bl/6j), самцы массой 25-27 г. Препарат вводили в виде суспензии однократно перорально в дозе равной 500 мг/кг.
Для оценки напряжения (уровня) кислорода в здоровой мышце животных использовали метод, основанный на тушении кислородом фосфоресценции сенсора — мезо-тетрафинил-тетрабензопорфина палладия (PdμPh4TBP).
Фосфоресценцию PdμPh4TBP возбуждали импульсами (t -20 мкс) He-Ne лазера (λ-633 нм, мощность 50 мВт). Кинетика затухания фосфоресценции, зависящей от парциального давления кислорода в окружающей сенсор биосреде, регистрировалась с помощью фотоумножителя. Регистрацию напряжения кислорода проводили в течение двух часов после введения БАД.
Выводы:
В результате проведенного исследования было установлено, что однократное пероральное применение БАД «Гитагамп — RI» в дозе 500 мг/кг отмечен (в виде тенденции) рост парциального давления в здоровой мышечной ткани мышей через 2 часа после применения с 27 +10 мм рт. ст. до 38+15 мм рт. ст.
Влияние «Гитагамп RI” на динамику роста первичной опухоли LLC. (Московский научно-исследовательский онкологический институт им. П.А. Гер-цена, ЗАО «НПК ЭХО»)
Мыши: BDF1, самки массой 20-22 г.
Опухоль: карцинома Легких Льюис (LLC) (перевивали внутримышечно по 30 мг опухолевого материала).
Лечение начинали через 48 ч. после перевивки LLC.
Рутин-железо вводили перорально ежедневно в разовых дозах 25 мг/кг и 125 мг/кг в течение 30 дней (курсовые дозы 757 мг/кг и 3750 мг/кг соответственно).
ТРО — торможение роста опухоли.
Вывод: В условиях приема препарата через 48 часов после прививки первичной опухоли «карцинома Легких Льюис (LLC)» практически никакого отрицательного действия (опухоль стимулирующего влияния) препарат не оказывает.
Заключение
Новое соединение играет роль внеклеточной «Каталазы». Причем вне зависимости от факторов, снижающих активность фермента каталазы.
При внешних воздействиях — (иони-зирующее излучение, или развитии стресса, развитии острых или хронических воспалений) — происходит увеличение ОВП за счет роста концентрации пероксида водорода. При нарушении ЕСЗ могут происходить существенные органические поражения.
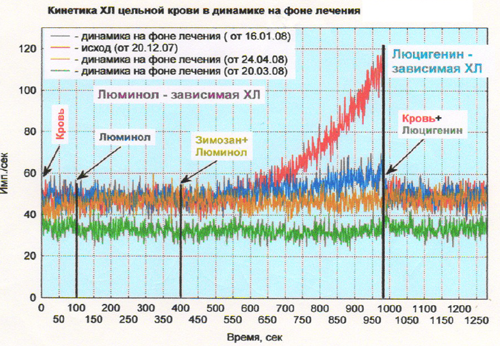
Способность Гитагампа — Рутин-железа эффективно нейтрализовать последствия развитии стресса, и развития острых или хронических воспалений иллюстрируется исследованиями хемилюминесценции цельной крови проведенными по методу профессора Новикова (МГУ Ломоносова). На рисунке видно, что уже после месячного курса происходит кардинальное снижение количества перекиси водорода.
Снижение интенсивного хемилюминесенции свидетельствует о снижении количества свободной перекиси в крови. Снижение происходит до уровня показателей молодого здорового организма.
СПИСОК ЛИТЕРАТУРЫ
1. Simon AS et al, “Altered DNA repair, oxidative stress and antioxidant status in coronary artery disease” Journal of Biosciences, 2013 Jun;38(2):385-9.
2. Hwang O, “ Role of oxidative stress in Parkinson’s disease” Experimental Neurobiology 2013 Mar;22(1):11-7.3. Koriyama Y, Nakayama Y, Matsugo S, Kato S , “Protective effect of lipoic acid against oxidative stress is mediated by Keap1/Nrf2-dependent heme oxygenase- 1 induction in the RGC-5 cellline” Braing Research, 2013 Mar 7;1499:145-57
4. М.Н.Захарова, Б.С.Народитский, Д.Ю.Логунов, И.Г.Гитлин. «Практическая медицина» 1(56) 2012г
5. Патент РФ 2309740, Евразийский патент 0166466, патент Китай ZL80033434.X, США, Канада
6. Ю.А. Александров. /.Основы радиационной экологии: Учебное пособие /Мар. гос. ун-т; – Йошкар-Ола, 2007/.
7. Стариков Юрий Витальевич, Автореферат, « Роль молекул оксида азота в программированной гибели нейтрофилов при окислительном стрессе». Новосибирск-2008,
8. Часовских Наталия Юрьевна «Молекулярные механизмы апоптоза при окислительном стрессе», Автореферат, Томск – 2009./
9. Influence of oxidative stress on redox-state and peripheral bloodheterophilic leucocytes apoptotic program realization / T.V. Zhavoronok, Ye.A. Stepovaya, N.V. Ryazanceva et al. // Eur. Journal of Nat. History. – 2007. – № 6. – P. 63-64/.
10. Жаворонок Т. В. «Редокс- зависимые механизмы изменений функциональных свойств нейтрофилов при остром воспалении и окислительном стрессе» Автореферат. Томск 2012
11. O. Grimstad, O. Sandanger, L. Ryan et al. «Cellular sources and inducers of cytokines present in acute wound fluid» / // Wound Repair Regen. 2011. - V. 19, N 3. - P. 337-347.
12. М. Ш. Хубутия и др «Измерения потенциала платинового электрода в крови, плазме и сыворотке крови» // Электрохимия, 2010, том 46, № 5, с. 569–573/
13. Никольский Б.П.,и др. Оксредметрия. Л.: Химия, 1975./
14. А.А. Подколзин и др. «Система антиоксидантной защиты организма и старение». Профилактика старения Выпуск 3 2000.


