Изучение способности композиции клеточных стенок Bifidobacterium bifidum и Saccharomyces cerevisiae активировать транскрипционный фактор NF-κB при взаимодейств
Тухватулин А.И., Гитлин И.Г., Калюжин О.В.
Научно-исследовательский институт эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи, Москва; Научно-исследовательский институт морфологии человека РАМН, Москва; Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва.
Некоторые высококонсервативные микробные молекулы через образраспознающие рецепторы (PRR) активируют врожденные защитные механизмы макроорганизма, а также индуцируют сигналы, контролирующие приобретенный иммунитет [10]. В связи с этим агонисты PRR, в частности Toll-подобные рецепторы (TLR), рассматривают в качестве эффективных средств, способных стимулировать противоинфекционный иммунный ответ [9].
TLRявляются сенсорами целого ряда молекулярных структур микроорганизмов, включая компоненты клеточных стенок бактерий (липополисахарид, липотейхоевая кислота, липопептиды и др.) и грибов (β-глюканы, маннаны) [1, 7].
Ранее нами предложено использование комбинации клеточных стенок бифидобактерий (Bifidobacterium bifidum) и пекарских дрожжей (Saccharomyces cerevisiae) в качестве иммуностимулирующего средства и продемонстрирована протективная активность этой композиции в условиях экспериментального сепсиса, вызванного минимальной летальной дозойStaphylococcusaureus[2].
Целью данной работы было изучить способность комплекса бактериальных и дрожжевых клеточных стенок вызывать TLR-опосредованную активацию одного из основных провоспалительных транскрипционных факторов – NF-κB.
Материалы и методы исследования
Препараты бактериальных и дрожжевых клеточных стенок
Препараты дрожжевых и бактериальных клеточных стенок (соответственно, ДКС и БКС) получали из автолизата Saccharomyces cerevisiae и сухих убитых клеток Bifidobacterium bifidum по модифицированному методу [3], как описано ранее [2]. В работе использовали смесь ДКС и БКС в весовом соотношении 5:1.
Кроме того, в работе использовали композицию ДКС и БКС, в которой БКС дополнительно обрабатывали лизоцимом. Для этого БКC растворяли в фосфатном буфере (1 мг/мл) и инкубировали с лизоцимом (Sigma-Aldrich, США) (1мг/мл) в течение 1 часа при +37ºС, затем проводили инактивацию фермента 5-минутным кипячением.
Клеточные линии и условия культивирования
В работе использованы клеточные линии HEK293-hTLR2/CD14, HEK293-hTLR4/CD14-MD2 и HEK293-hTLR5 (InvivoGen, США), экспрессирующих TLR2/CD14, TLR4/CD14-MD2 и TLR5, соответственно, и содержащих в своем геноме репортерный ген β-галактозидазы под контролем NF-κB-зависимого промоутера.
Для подтверждения специфичности взаимодействия молекул исследуемого образца с TLR в качестве контроля использовали клетки HEK293-hTLRnull(InvivoGen, США), не экспрессирующие TLR, однако имеющие ген β-галактозидазы, контролируемый NF-κB-зависимым промоутером.
Для пассажа клеточных линий и экспериментов in vitro применяли среду DMEM (Thermo Scientific, США) с добавлением 10% эмбриональной телячьей сыворотки (Hyclone, США), 1 мг/мл глютамина, 50 Ед/мл пенициллина, 50 мкг/мл стрептомицина (ПанЭко, Россия).
Культуры клеток инкубировали при +37ºC в атмосфере увлажненного воздуха, содержащего 5% СО2.
Исследование взаимодействия с Toll-подобными рецепторами
Клетки HEK293-hTLR2/CD14, HEK293-hTLR4/CD14-MD2, HEK293-hTLR5, HEK293-hTLRnullбыли рассеяны на 96-луночный плоскодонный планшет (Corning, США) из расчета 2x104 клеток на лунку. Объем среды в лунке составлял 100 мкл. После рассева клеток планшет инкубировали в течение 24 часов. Затем к клеткам добавляли смесь ДКС и БКС в 10 мкл культуральной среды в последовательных десятикратных разведениях (конечные концентрации: 600, 60, 6, 0,6 мкг/мл и в некоторых случаях 60 нг/мл).
В качестве положительного контроля, подтверждающего функциональность TLR различных клеточных линий, использовали клетки, к которым добавляли известные лиганды соответствующих рецепторов в конечной концентрации 200 нг/мл: синтетический липопептид Pam2CSK4 (Rpam) (InvivoGen, США) – TLR2; липополисахарид (ЛПС), выделенный из E.coli 055:B5 и очищенный гель-фильтрацией (Sigma-Aldrich, США), – TLR4; флагеллин (FliC), выделенный изSalmonellatyphimurium(InvivoGen, США), – TLR5.
Отрицательным контролем служили интактные клетки без добавления исследуемой композиции и референс-лигандов.
Для клеточной линии, не экспрессирующей TLR(HEK293-hTLRnull), положительный контроль составляли клетки, к которым добавляли рекомбинантный фактор некроза опухоли (TNF), который, взаимодействуя с соответствующим рецептором (TNFR) на поверхности клеток, способен активировать транскрипционный фактор NF-κB, инициируя экспрессию репортерного гена β-галактозидазы.
Через 72 часа после добавления препаратов проводили измерение уровня экспрессии β-галактозидазы.
Для каждого разведения исследуемой комбинации БКС и ДКС и для каждого варианта контроля использовали по 3 лунки.
Определение уровня экспрессии β-галактозидазы
Ферментативную активность β-галактозидазы оценивали колориметрическим методом, определяя скорость расщепления неокрашенного субстрата – орто-нитрофенил-β-В-галактопиранозида (ONPG) – в окрашенный продукт – орто-нитрофенол. Оптическая плотность раствора прямо пропорциональна уровню активности репортерного гена β-галактозидазы, который в свою очередь прямо пропорционален степени взаимодействия анализируемых молекул образца с определенным типом TLR.
Для этого использовали 0,2-процентный раствор ONPG в буфере.
Приготовление буфера: 0,1 мл 1 М MgCl2; 12,5 мл 2 М Tris-HCl (рН 7,4); 0,2 мл 10% раствора NP40; дистиллированная вода - до 100 мл.
Из лунок планшета полностью удаляли культуральную среду и добавляли по 100 мкл раствора ONPGв буфере. Планшет инкубировали при +37°С в течение 0,5-2 часов в зависимости от скорости развития окраски. Измерение оптической плотности проводили на спектрофотометреiEMS 96 wellMicroplateReader (PerkinElmer, USA) при длине волны 414 нм.
Цитотоксическое действие анализируемых образцов было определено на культурах вышеуказанных клеток методом окраски метиленовым синим [4].
Статистическая обработка материала
Математическую обработку полученных результатов проводили с помощью программы Statistica 7.0. Для оценки достоверности различий количественных показателей между двумя независимыми выборками использовали U-критерий Манна-Уитни, между двумя связанными выборками - критерий Вилкоксона. Различие считали достоверным при p<0,05.
Результаты исследований и их обсуждение.
Известно, что агонистами TLR2 могут являться фрагменты пептидогликана бактериальных клеточных стенок и связанные с ними другие биологически активные молекулы, такие как липопептиды. В связи с этим одной из задач исследования было определить, возможно ли при снижении степени полимеризации пептидогликана и высвобождении дополнительных порций его фрагментов и ассоциированных с ними молекул повысить TLR2-опосредованную активность изучаемой композиции микробных клеточных стенок. Для этого дополнительно исследовали NF-κB-активирующую способность смеси ДКС и БКС, в которой последние были обработаны лизоцимом для разрушения β-1,4-гликозидной связи между N-ацетилмурамовой кислотой и N-ацетилглюкозамином в структуре пептидогликана.
Исследуемая комбинация ДКС и БКС, как и их композиция с БКС, обработанными лизоцимом (БКС-лиз), в диапазоне концентраций от 0,6 до 600 мкг/мл не оказывала токсического действия на все клеточные линии, использованные в настоящей работе. Эти данные важны с той точки зрения, что цитотоксичность может стать причиной неспецифической активации NF-κB и, как следствие, повышения уровня экспрессии β-галактозидазы.
Комплекс БКС+ДКС дозозависимо стимулировал TLR2-опосредованную активацию NF-κB (рис. 1). В наибольшей из использованных концентраций (600 мкг/мл) композиция ДКС+БКС вызывала активацию NF-κB-зависимой экспрессии β-галактозидазы примерно в той же степени, что и референс-лиганд TLR2 (Rpam) в дозе 200 нг/мл. Дополнительная обработка БКС лизоцимом несколько снижала биологическую активность исследуемой комбинации в концентрации 600 мкг/мл, практически не влияя на активность композиции микробных клеточных стенок в более низких дозах.
При изучении способности комбинаций ДКС+БКС и ДКС+БКС-лиз вызывать TLR2-опосредованную активацию NF-κB на клетках HEK293-hTLR4/CD14-MD2 четкой дозозависимости биологического действия не выявлено (рис. 2). В этом отношении композиции ДКС+БКС и ДКС+БКС-лиз были эффективны только в максимальной концентрации (600 мкг/мл), при этом предобработка БКС лизоцимом снижала активность исследуемой комбинации клеточных стенок. Референс-агонист TLR4 (ЛПС) в дозе 200 нг/мл превосходил по биологической активности обе композиции. ДКС+БКС и ДКС+БКС-лиз в диапазоне концентраций 0,06–60 мкг и 0,6–60 мкг, соответственно, проявляли лишь незначительную тенденцию к активации NF-κB-зависимой экспрессии β-галактозидазы.
В опытах на клетках HEK293-hTLR5 установлено, что комбинации ДКС+БКС и ДКС+БКС-лиз не индуцируют TLR5-зависимых сигналов, активирующих NF-κB. Референс-лиганд TLR5 (FliC) в концентрации 200 нг/мл увеличивал в 2,5 раза активность β-галактозидазы, ген которой контролируется NF-κB-зависимым промоутером.
Также не выявлено влияния композиций микробных клеточных стенок на активность NF-κB на клеточной линии HEK293-hTLRnull, не экспрессирующей TLR. TNF, служивший в этом случае положительным контролем, в концентрации 20 нг/мл увеличивал вдвое NF-κB-зависимую экспрессию β-галактозидазы.
Ранее мы показали, что клеточные стенки Bifidobacterium bifidum и таковые Saccharomyces cerevisiae действуют синергично по предотвращению гибели животных в условиях экспериментального сепсиса [2]. Это согласуется с данными других исследователей о том, что при сочетанном использовании компонентов бактериальных и дрожжевых клеточных стенок, действующих как через разные, так и через некоторые общие рецепторно-сигнальные системы, возможен синергизм в активации иммунокомпетентных клеток [5, 8].
Очевидно, установленная ранее протективная активность исследуемой композиции в значительной степени связана с выявленной в настоящей работе способностью взаимодействовать с TLR2 и TLR4. Вероятно, основными лигандами, связывающими TLR2 и обусловливающими дальнейший активационный каскад, являются липопротеины, ассоциированные с пептидогликанами БКС [11]. Возможно также участие β-(1,3)/(1,6)-глюканов ДКС в TLR2-зависимой активации NF-κB [6]. Что касается TLR4, то наиболее вероятным агонистами этого рецептора в составе исследуемой композиции являются маннаны дрожжевых клеточных стенок [12].
Таким образом, композиция клеточных стенок Saccharomyces cerevisiae иBifidobacterium bifidum активирует транскрипционный фактор NF-κB, взаимодействуя с TLR2 и TLR4, но не TLR5. При этом выявлена четкая дозозависимость TLR2-опосредованных сигналов. Предварительная обработка бактериальных клеточных стенок лизоцимом несколько снижает биологическую активность комбинации микробных клеточных стенок. В концентрациях, вызывающих TLR2- и TLR4-зависимую активацию NF-κB, исследуемая композиция не оказывает токсического действия на клетки, экспрессирующие вышеуказанные рецепторы.
Литература
1.Афанасьев С.С., Алешкин В.А., Байракова Е.А. и др. Молекулярные механизмы индукции врожденного иммунитета // Вестник РАМН. 2009. № 4. С. 42-49.
2.Калюжин О.В., Гитлин И.Г., Калина Н.Г. и др. Влияние композиции клеточных стенок Bifidobacterium bifidum и Saccharomyces cerevisiae на выживаемость мышей в условиях экспериментального сепсиса // Курский научно-практический вестник «Человек и его здоровье». – 2012. – № 3. – 10-14.
3.Bacon J.S.D., Davidson V.C., Jones D., Taylor I.F., The glucan components of the cell wall of Baker's yeast (Saccharomyces cerevisiae) considered in relation to its ultrastructure // Biochemical Journal – 1969. – Vol. 114. – P. 557-569.
4.Bianchi-Smiraglia A., Paesante S., Bakin A.V. Integrin β5 contributes to the tumorigenic potential of breast cancer cells through the Src-FAK and MEK-ERK signaling pathways // Oncogene. – 2012. – doi:10.1038/onc.2012.320.
5.Huang H., Ostroff G.R., Lee C.K. et al. Distinct pattern of dendritic cell cytokine release stimulated by fungal β-glucans and Toll-like receptor agonists // Infection and Immunity. – 2009. – Vol. 77 (5). – P. 1774-1781.
6.Ikeda Y., Adachi Y., Ishii T. et al. Dissociation of toll-like receptor 2-mediated innate immune response to zymosan by organic solvent-treatment without loss of Dectin-1 reactivity // Biol. Pharm. Bull. – 2008. – Vol. 31 (1). – P. 13-18.
7.Kawai T., Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition // Int. Immunol. – 2009. – 21 (4). – P. 317-337.
8.Kikkert R., Bulder I., de Groot E.R. et al. Potentiation of Toll-like receptor-induced cytokine production by (1-->3)-beta-D-glucans: implications for the monocyte activation test // J. Endotoxin Res. – 2007. – Vol. 13 (3). – P. 140-149.
9.O'Neill L.A., Bryant C.E., Doyle S.L. Therapeutic targeting of toll-like receptors for infectious and inflammatory diseases and cancer // Pharmacol. Rev. –2009. – Vol. 61 (2). – P. 177-197.
10.Palm N.W., Medzhitov R. Pattern recognition receptors and control of adaptive immunity // Immunol. Rev. – 2009. – Vol. 227 (1). – P. 221-233.
11.Rockel C., Hartung T.Systematic review of membrane components of gram-positive bacteria responsible as pyrogens for inducing human monocyte/macrophage cytokine release // Front. Pharmacol. – 2012. – Vol. 3. – Art. 56. – doi: 10.3389/fphar.2012.00056.
12. Tada H., Nemoto E., Shimauchi H. et al. Saccharomyces cerevisiae- and Candida albicans-derived mannan induced production of tumor necrosis factor alpha by human monocytes in a CD14- and Toll-like receptor 4-dependent manner // Microbiol. Immunol. – 2002. – Vol. 46 (7). – P. 503-512.
Рисунок 1
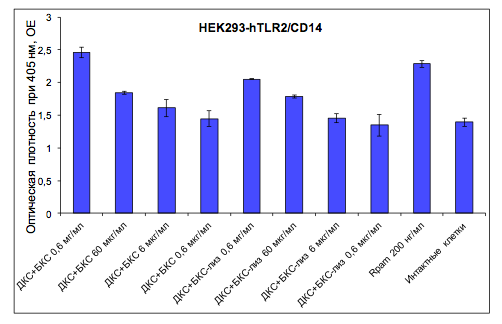
Способность композиции клеточных стенок Saccharomycescerevisiae и Bifidobacteriumbifidum активировать NF-κBчерезTLR2/CD14-рецепторную систему
Рисунок 2
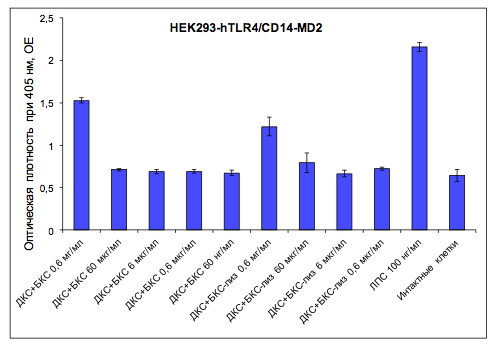
Способность композиции клеточных стенок Saccharomycescerevisiae иBifidobacteriumbifidumактивировать NF-κB черезTLR4/CD14-MD2- рецепторную систему
Реферат
Целью работы было изучить способность композиции клеточных стенок Saccharomyces cerevisiae иBifidobacterium bifidum вызывать TLR-опосредованную активацию транскрипционного фактора NF-κB на клетках HEK293-hTLR2/CD14, HEK293-hTLR4/CD14-MD2, HEK293-hTLR5, HEK293-hTLRnull. Установлено, что комбинация микробных клеточных стенок активирует NF-κB, взаимодействуя с TLR2 и TLR4, но не TLR5. Предварительная обработка бактериальных клеточных стенок лизоцимом несколько снижает биологическую активность исследуемой композиции.
Ключевые слова: Saccharomyces cerevisiae, Bifidobacterium bifidum,клеточные стенки,TLR2, TLR4, TLR5, NF-κB


